| Специалистам > Лечение и
реабилитация > Хирургическое лечение
Повреждения позвоночника и спинного мозга.
Под ред. Н. Е. Полищука, Н. А. Коржа, В. Я. Фищенко.
Киев: "КНИГА плюс", 2001.
Часть I. Анатомия, механизмы и патогенез
повреждений позвоночника и спинного мозга
Глава 3. Патогенез травмы спинного мозга, периодизация травматической
болезни спинного мозга. Спинальный шок
Н. Е. ПОЛИЩУК, Е. И. СЛЫНЬКО
С УВЕЛИЧЕНИЕМ скорости и мощности средств передвижения частота травмы спинного
мозга возрастает. В Соединенных Штатах Америки ежегодно регистрируется 8 000-10
000 случаев этого вида травмы (Villanueva, 1994), в Украине - 1500-2000 случаев
спинномозговой травмы в год.
Генез травматических повреждений спинного мозга различен, они могут быть вызваны
такими факторами (Quencer, 1992):
а) костными или инородными отломками, проникшими в позвоночный канал;
б) воздействием компримирующих сил на спинной мозг или;
в) механизмов чрезмерного растяжения спинного мозга;
г) ишемическими нарушениями, обусловливающими вторичные повреждения спинного
мозга.
Среди травматических поражений самого спинного мозга различают следующие клинические
формы:
1. Сотрясение.
2. Ушиб.
3. Размозжение с частичным нарушением анатомической целости или с перерывом
спинного мозга.
4. Гематомиелию.
5. Эпидуральное, субдуральное и субарахноидальное кровоизлияния.
6. Травматический радикулит.
При спинномозговой травме повреждаются как спинной мозг, так и его оболочки.
Повреждение оболочки при закрытых травмах позвоночника возможно главным образом
осколками сломанных дужек. При спинномозговой травме не остаются интактными
и корешки. В них нередко отмечаются кровоподтеки, участки некроза, вызываемые
расстройствами кровообращения, или даже разрывы.
Неврологический дефицит встречается у 25% пострадавших с костными повреждениями
позвоночника. Области наибольшей мобильности позвоночника повреждаются чаще
всего. Более чем в половине случаев полное повреждение спинного мозга совпадает
с травмой среднего и нижнего шейного отделов позвоночника (Levi, 1993). Немного
менее половины случаев полного повреждения спинного мозга отмечается при повреждениях
тораколюмбарного отдела позвоночника. Однако большинство травм позвоночника
происходит без какого-либо неврологического дефекта (Wilcox,1972).
При аутопсии повреждения спинного мозга обнаруживаются не только на уровне
травмы, но и в точках, которые находятся на 2-3 сегмента выше и ниже травмы.
Травматические изменения спинного мозга делятся на ранние и поздние.
К ранним видимым изменениям относятся:
1. Разрыв спинного мозга или частичное нарушение его целостности.
2. Размозжение спинного мозга.
3. Отек спинного мозга.
4. Острое посттравматическое размягчение спинного мозга.
5. Частичное изменение структуры мозга.
6. Внутримозговое, субарахноидальное кровоизлияние.
При уточнении той или иной формы повреждения спинного мозга необходимо иметь
в виду, что в клиническом течении повреждений позвоночника и спинного мозга
различают четыре периода (А.В. Лившиц, 1990; Duh, 1994): острый, ранний, промежуточный
и поздний.
Острый период продолжается 2-3 суток. Проявления различной степени повреждений
спинного мозга могут быть сходными в этот период, поскольку клиническая картина
в острый период может быть обусловлена спинальным шоком.
Ранний период длится последующие 2-3 недели. В этот период, как и в
острый, при повреждениях спинного мозга различной степени может наблюдаться
синдром полного нарушения проводимости спинного мозга вследствие спинального
шока, нарушений крово- и ликвородинамики, отека и набухания спинного мозга (Albin,
1985).
Промежуточный период продолжается до 2-3 мес. В начале этого периода
(на протяжении 5-6 нед. после повреждения) исчезают явления спинального шока,
отека спинного мозга и выявляется истинный характер и объм повреждения - ушиб
спинного мозга, частичное или полное нарушение неврологических функций ниже
уровня поражения (Tator, 1991).
Поздний период длится с 3-4-го месяца до 2-3 лет после травмирования.
В это время происходит восстановление функций спинного мозга, в зависимости
от тяжести повреждений. Функции спинного мозга восстанавливаются в течение 5-10
лет после травмы. В этот период возможно отдаленное усугубление неврологической
симптоматики в результате развития рубцового процесса, кистообразования, возникновения
посттравматической сирингимиелии, прогрессирования кифотической деформации позвоночника,
явлений нестабильности с поздней компрессией спинного мозга (Villanueva, 1994).
Патогенез травмы спинного мозга характеризуется уникальным сочетанием и динамическим
развитием патофизиологических факторов и во многом зависит от морфологических
нарушений, степень которых бывает различной (Klose,1980;Guttmann, 1973; Green,
1991). Макроскопически спинной мозг может выглядеть отечным, с элементами кровоизлияний,
контузии, разрывом или без них. Нарушение проводимости спинного мозга и его
сегментарных функций обусловлено не только анатомическими повреждениями аксонов,
нейронов, но и патологическими факторами, которые начинают воздействовать в
острый период травмы. Вследствие наличия этих факторов степень морфологических
нарушений в спинном мозге часто не соответствует степени функциональных (неврологических)
нарушений. Одним из важнейших факторов, которые "запускаются" в острый
период травмы является отек спинного мозга (Green, 1993).
Отек спинного мозга бывает настолько обширным, что захватывает несколько сегментов,
распространяясь в краниальном и каудальном направлениях. Это сопровождается
потерей ауторегуляции кровотока. Огромную роль в патогенезе спинномозговых поражений
играют сосудистые посттравматические нарушения ишемического или геморрагического
типа. Даже небольшое сдавление спинного мозга вызывает значительное снижение
спинномозгового кровотока, который может компенсироваться механизмами вазодилатации
или образованием артериальных коллатералей на уровне очага поражения. В прилегающих
сегментах, которые не получают в этих условиях достаточного притока крови, продолжается
уменьшение спинномозгового кровотока. Если компрессия спинного мозга возрастает,
то кровоток значительно уменьшается на уровне сдавления, т. е. в очаге поражения.
При ликвидации компрессии наблюдается реактивная гиперемия. В патологических
условиях при отеке или сдавлении спинного мозга гемодинамическая ауторегуляция
нарушается или исчезает и кровоток становится зависимым, главным образом, от
системного давления. Накопление кислых метаболитов и углекислоты в поврежденном
участке вызывает расширение сосудов, не купирующееся терапевтическими средствами.
Присоединение сосудистого фактора объясняет часто встречающееся несоответствие
между уровнем повреждения позвонков и клиническими симптомами поражения спинного
мозга (Green, 1987, 1989; Geisler, 1991). Возникающий при повреждении очаг размягчения
распространяется кверху и книзу от места поражения. После травмы спинного мозга
аутодеструктивные процессы ведут к увеличению тканевого некроза. В дополнение
к геморрагиям, ишемии, отеку, нейронофагии, потере экстрацеллюляр-ного кальция
и интрацеллюлярного калия происходят обусловленная травмой пероксидация липидов
и гидролиз в клеточных мембранах, что,в свою очередь, непосредственно повреждает
клеточные мембраны, а гидролиз, кроме того, ведет к образованию биологически
активных простагландинов (Fagan, 1986; Faden, 1988). Как следует из работы D.
Anderson (1985), нарушение уровня липидов мембран вследствие изменения действия
антиоксидантов при травмах спинного мозга свидетельствует о том, что посттравматическая
ишемия, отек и электролитные расстройства являются результатом мембранных пероксидазных
реакций и липолиза с образованием вазо-активных и гемоактивных простагландинов
(Demediuk, 1985).
Повреждение спинного мозга обусловливает нарушения энергетических процессов
и переход к анаэробному гликолизу, что обедняет мозг макроэргическими соединениями
(аденозинтрифосфат и фосфокреатинин) и приводит к значительному увеличению содержания
лактата (Braughler,1984). При травме в спинном мозге изменяется напряжение кислорода,
отмечаются изменение концентрации натрия и калия, вторичное по отношению к тканевому
некрозу и отеку, выброс лизосомальных ферментов, участвующих в развитии повреждения,
увеличение концентрации адреналина в сером веществе поврежденного спинного мозга
(Bracken,1992). В последнее время в литературе дискутируется роль эуказаноидов
в патогенезе спинальной травмы (Hsu, 1985, 1986, 1988; Kiwak, 1985; Mitsuhashi,
1994; Sharma, 1993; Tempel, 1992; Winkler, 1993). К эуказаноидам относят метаболиты
арахидоновой кислоты - тромбоксан А2, простагландин 12. Распад миелиновых оболочек,
нарушение перикисного окисления липидов приводят к локальному выделению большого
количества эуказаноидов. Важнейшей ролью тромбоксана А2 и простогландина 12
в патогенезе спинальной травмы является их влияние на сосудистую регуляцию.
Тромбоксан приводит к вазоконстрик-ции, в то время как простагландин играет
противоположную роль. При спинальной травме обнаружено повышенное содержание
эуказаноидов как в ликворе, так и в зоне травматического повреждения спинного
мозга. Отмечается корреляция тяжести травмы и содержания эуказаноидов в ликворе.
Патофизиологические (биохимические) изменения при травме спинного мозга отражены
в следующей схеме:
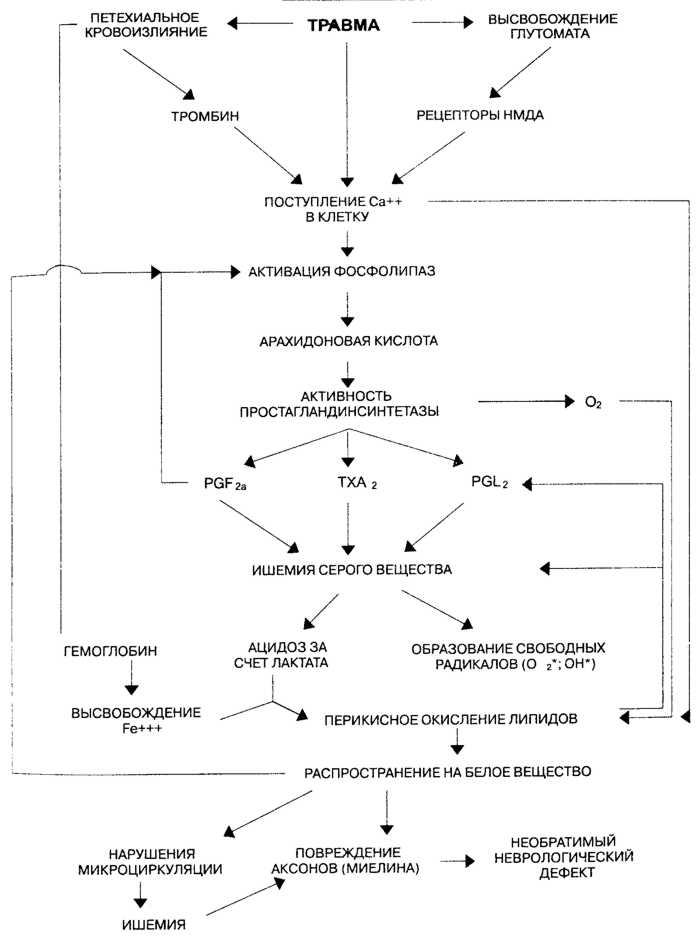
Патофизиологические (биохимические) изменения при травме спинного мозга
Микроангиографические исследования при экспериментальной травме спинного мозга
и его компрессии обнаруживают некроз центрального серого вещества через 4 ч,
в это же время определяются пик уровня адреналина и отек окружающего белого
вещества. Аксональная и нейрональная дегенерация проявляется к 8-му часу. Некротические
изменения в белом веществе наступают несколько позже, и это открывает перспективы
для предупреждения дальнейшего поражения при активной лечебной тактике в первые
часы после травмы (Griffiths, 1975; Tator, 1991).
В острый период, охватывающий первые 2~3 сут. возникает первичный травматический
некроз, обусловленный как непосредственным повреждением и отеком спинного мозга,
так и расстройством ликворо- и кровообращения. При травмах шейного отдела спинного
мозга отек является одной из основных причин летального исхода.
Первичный некроз больше распространяется по поперечнику спинного мозга, больше
чем по длиннику. Несмотря на то, что во время операции морфологические изменения
не выявляются, патолого-анатомические исследования нередко определяют полный
анатомический перерыв спинного мозга (Villanueva,1994). При анатомическом перерыве
концы спинного мозга размягчены, с неровными краями, могут отстоять друг от
друга на несколько сантиметров. Сочетание первичного и вторичного некрозов обусловливает
распространенность некротических изменений спинного мозга, выходящих далеко
за пределы непосредственного травматического воздействия. Как показали морфологические
исследования, проведенные на собаках (Г.Н. Кривицкая и др., 1980), при полной
перерезке спинного мозга через 8-10 дней обнаруживаются некроз и распад ткани
в области травмы. Одновременно отмечается пролиферативная реакция с новообразованием
сосудов, а также аргирофильных и коллагеновых соединительнотканных волокон.
У животных через 14-21 день после перерезки отмечаются новообразования сосудов,
гипертрофия и гиперплазия всех типов глии вокруг места перерезки. На концах
нервных волокон пирамидного тракта (на 3-4 сегмента выше перерезки) выявляется
значительное увеличение нервных волокон, имеющих колбы роста, шары раздражения.
Происходит образование нежного глиоволокнистого рубца. Ниже места перерезки
спинного мозга в пирамидном тракте наблюдается тотальная демиелинизация нервных
волокон. В этот период можно отметить организацию очагов повреждения спинного
мозга, уменьшение циркуляторных расстройств, отека. Через 1-2 мес после перерезки
спинного мозга формируется грубый соединительнотканный рубец, расположенный
в поперечном направлении по отношению к нисходящим и восходящим волокнам спинного
мозга. На несколько сегментов выше и ниже рубца отмечаются дегенерация и гибель
нервных волокон и нейронов, однако большая часть их в этих отделах сохраняет
свою структуру. В части волокон отмечена типичная картина ретроградной дегенерации
(в обоих отрезках). На концах нервных волокон выявляются колбы роста, тонкие
нервные волоконца с небольшими натеками между измененными, деформированными
и фрагментированными волокнами аналогичной с ними ориентировки.
Через 3 мес после перерезки спинного мозга на границе очага развивается грануляционная
ткань с образованием ме-зенхимальных зернистых шаров. Наиболее частыми источниками
пролиферации становятся серое вещество и мягкая оболочка. Одновременно обнаруживаются
явления вторичной дегенерации. Организация очага повреждения спинного мозга
заканчивается соединительнотканным рубцом. Через 3-4 мес выше и ниже места перерезки
зона повреждения уменьшается, стягивается плотным или рыхлым соединительнотканным
рубцом поперек хода волокон спинного мозга. Через 4,5-5,5 мес в отделе спинного
мозга, расположенном выше рубца, нейроны не имеют признаков ретроградной дегенерации,
слегка гипертрофированные, гиперхромные, некоторые из них двуядерные. У тел
нервных клеток иногда отмечаются единичные гипертрофированные синапсы. Нервные
волокна пирамидного тракта ниже места перерезки деформированы и фрагментированы.
Выше и ниже места травмы наблюдаются тонкие волоконца с колбами роста. Некоторые
волокна подходят к рубцу и имеют по 2~3 разветвления. У ряда нервных волокон,
оканчивающихся недалеко от рубца, нет утолщений и натеков. На продольных срезах
удается идентифицировать лишь пирамидный тракт. Через 6-9 мес после полной перерезки
обнаруживается плотный коллагеновый рубец, идущий поперек спинного мозга. Волокна,
замурованные в рубце, колб роста не имеют. Нервные клетки выше и ниже рубца
изредка гипертрофированы, часть их содержит в цитоплазме укрупненные или гигантские
глыбки базофильной зернистости. Многие клетки с явлениями гиперхроматоза окружены
большим количеством ядер олигодендроглии. На поперечных срезах выше рубца в
пирамидных трактах наблюдаются гипертрофированные осевые цилиндры, отличающиеся
от расположенных рядом объемом и формой. Гипертрофированные осевые цилиндры
имеют утолщенную миелиновую кайму, также неравномерно окрашенную и часто деформированную
(Т.Н. Кривицкая и др., 1980). Через 2 года выше места повреждения при частичном
повреждении спинного мозга обнаруживаются пучки дегенерированных нервных волокон,
а также гиперимпрегнированные утолщенные волокна и хаотично расположенные, образующие
разрастания, тонкие нервные волоконца. Наибольший интерес представляют появление
тонких нервных волокон в очаге поражения и увеличение их количества пропорционально
времени существования очага повреждения. Увеличение нервных волокон, особенно
при половинной перерезке, сопровождается улучшением двигательных функций. Однако
зона деструкции никогда не заполняется полностью волоконцами малого калибра,
хотя со временем она резко уменьшается.
Морфологические исследования поврежденного спинного мозга человека показали,
что наиболее ранимо серое вещество центральных областей спинного мозга. Некротические
изменения чаще всего асимметричны и распространяются рострально и каудально
без расширения внеклеточных пространств и разрушения белого вещества.
Прогрессирующий центральный некроз серого вещества с кистозными изменениями
и вакуолизацией в дальнейшем распространяется и на белое вещество. Реакция пограничных
и отдаленных тканей на продукты тканевого распада и инородные тела, циркуляторные
и аутодеструктивные процессы проявляются во вторичных некрозах, отечном расплавлении,
негнойных миелитах, лептоменингитах, диффузных и ограниченных глиальных реакциях,
восходящих и нисходящих дегенерациях, рубцово-спаечных перерождениях.
Проведенные анатомо-клинические сопоставления травматического повреждения спинного
мозга у человека обнаружили отсутствие корреляции глубины анатомического повреждения
спинного мозга и глубины выраженности неврологического дефицита. Интересной
находкой явилось то, что, несмотря на регресс неврологического дефицита, выраженность
морфологических нарушений спинного мозга в течение первой недели после травмы
может усугубляться. Выявлено также, что независимо от механизма травмы вначале
наибольшие изменения спинного мозга выявляются в его центральной части. Это
проявляется кровоизлиянием в серое вещество с последующим его отеком и некрозом.
В более поздний периоде процесс распространяется на белое вещество, начинается
его демиелинизация. В итоге в процесс вовлекается весь поперечник спинного мозга.
Авторы обнаружили зависимость между выраженностью повреждения и силой приложенной
травмы: при минимальной травме повреждается только серое вещество, при более
серьезной травме повреждается серое вещество и прилежащие отделы белого вещества,
при грубой травме поражается весь поперечник спинного мозга. Вторичное повреждение
аксонов может быть обусловлено резким отеком серого вещества и его давлением
на окружающие аксоны в белом веществе или же распространением геморрагии с серого
вещества на белое (Quencer, 1992).
Глубина сосудистых нарушений спинного мозга не одинакова. Наиболее чувствительным
к сосудистым повреждениям является серое вещество (Tator, 1991). В нем чаще
всего наблюдаются небольшие очаги геморрагии. Разрывы сосудов, тромбоз сосудов,
геморрагические экстравазаты - наиболее часто выявляемые сосудистые повреждения.
Спинальная ангиография у больных с позвоночно спинальной травмой, обнаруживала
явления тромбоза сегментарных сосудов, а также спазм вертебральных сосудов и
нарушение кровотока в сосудах шейного отдела спинного мозга и даже в задних
мозговых артериях, что было подтверждено данными УЗДГ. Ahmann (1975) сообщает
о нескольких случаях глубокого неврологического дефицита после незначительной
травмы. Гистологические исследования выявили инфаркт спинного мозга вследствие
тромбоза сосудов.
В поздний травматический период морфологические изменения проявляются в виде
кистозной дегенерации спинного мозга, фиброзного перерождения его, образования
сосудистых лакун, формирования перимедуллярных рубцов, вызывающих грубую компрессию
спинного мозга (А.В. Лившиц, 1990).
Отдаленная кистозная дегенерация спинного мозга приводит к формированию посттравматической
сирингомиелии, которая проявляется усугублением неврологических нарушений в
отдаленный период травмы. Обычно киста расположена центромеддулярно на большом
протяжении, значительно превышающем размеры места травмы, и является трансформацией
центромедуллярной гематомиелии. Динамическое МРТ исследование в разные периоды
после травмы дает более полное представление о посттравматической гематомиелии.
Формирование перимедуллярных рубцов и фиброзное перерождение спинного мозга,
как известно, являются наиболее частыми причинами позднего усугубления неврологического
дефицита у больных с травмой.
Новые литературные данные и наши наблюдения по патофизиологии и морфологии
травмы спинного мозга дают основание пересмотреть периодизацию этого вида травмы.
Определение периодов в течении травматической болезни спинного мозга базируются
на таких критериях: клинических (спинномозговой, общеорганизменный, спинальный
шок, корешковые нарушения и их динамика), патофизиологических (отек, набухание,
сосудистые, нейрофизиологические, нейромедиаторные, гормональные нарушения),
и морфологических (морфологический субстрат, динамика его санации и организации).
В этой связи целесообразно выделить три основных периода травматической болезни
спинного мозга - острый, промежуточный, отдаленный.
Основу острого периода определяют взаимодействия травматического субстрата,
реакции повреждения и защиты. Промежуточный период должен обеспечивать рассасывание
и организацию участков повреждения, развертывание компенсаторно - приспособительных
процессов. В отдаленный период завершаются местные и дистантные деструктивные
дистрофические и репаративно-регенеративные процессы и формируются условия для
их сосуществования. При благоприятном течении заболевания наблюдается клиническое
уравновешивание обусловленных травмой спинного мозга изменений. При неблагоприятном
его течении отмечаются клинические проявления вызванных травмой спаечно-рубцовых
процессов, аутоиммунных и вегетативных нарушений.
Учитывая вышесказанное, необходимо пересмотреть временную протяженность периодов
травматической болезни спинного мозга. Основой для этого служит клиническое
течение повреждений спинного мозга. Острый период травмы спинного мозга может
длиться от 1 до 8-10 недель: при сотрясении спинного мозга - от 1 до 2 нед.;
при ушибе продолжительность острого периода составляет от 1 до 8-10 нед. Признаком
протяженности острого периода может быть продолжительность спинального шока.
Появление спинальных автоматизмов при грубых повреждениях спинного мозга свидетельствует
о завершении острого и начале промежуточного периода. Протяженность промежуточного
периода при легких травмах длится до 2 мес, при травмах средней тяжести - до
4 мес, при тяжелых - до 1 года. Отдаленный период при клиническом выздоровлении
длится до 2 лет, при наличии проводниковых, трофических нарушений или при проградиентном
течении травматической болезни продолжительность его не ограничена.
Такое разделение течения травматической болезни спинного мозга на периоды во
многом оправдано не только патоморфологическими и клиническими изменениями при
ней, но и особенностями лечебной тактики и экспертизы спинальных повреждений.
Неврологические нарушения при травме спинного мозга сложны и часто не коррелируют
с морфологическими нарушениями в спинном мозге. Принято различать полное и неполное
неврологическое повреждение. Больные с отсутствием чувствительности и движений
ниже уровня повреждения рассматриваются как имеющие полный неврологический дефицит.
Неполный неврологический дефицит диагностируется при наличии чувствительности
и движений ниже уровня повреждения. По данным Американского статистического
центра спинальной травмы, более чем у половины больных с травмой спинного мозга
поражение неполное. Концептуальная важность такого деления обусловлена тем,
что у больных с полным функциональным повреждением какое либо неврологическое
восстановление наблюдается редко. В то же время у больных с неполным неврологическим
нарушением часто отмечается улучшение.
Неврологическая картина спинальной травмы отличается фазностъю. В острый
период выраженность неврологического дефицита обусловлена явлениями спиналъного
шока. В промежуточный период после ликвидаци спинального шока на первый
план выступает реальный неврологический дефект, обусловленный анатомофизиологическими
повреждениями спинного мозга. Впоследствии наблюдается частичный регресс неврологической
симптоматики. В отдаленный период остается резидуальная неврологическая симптоматика.
Вследствие вторичных, отдаленных изменений в спинном мозге неврологическая симптоматика
может усугубляться.
Глубокий неврологический дефицит в острый период может быть обусловлен не только
спинальным шоком, но и ушибом спинного мозга. В последующем возможен
значительный регресс неврологической симптоматики. В таких случаях возникают
сложности в дифференциальной диагностике спинального шока и ушиба спинного мозга.
Ушиб спинного мозга предполагает грубые морфологические изменения в спинном
мозге, сопровождающиеся серьезными неврологическими нарушениями. Поэтому в случаях
значительного регресса вначале выраженной неврологической симптоматики следует
диагностировать спинальный шок, а не ушиб спинного мозга.
Спинальный шок - патофизиологическое состояние, характеризующееся нарушением
моторной, сенсорной и рефлекторной функций спинного мозга ниже места травмы.
Для шока характерна вялая плегия конечностей. Спинальный шок разрешается в течение
часов, дней, иногда недель после травмы. Шок встречается при травме ствола головного
мозга, травме шейного и верхнегрудного отделов позвоночника. Механизм шока заключается
в нарушении регуляторных влияний с верхних автономных центров шейного и верхнегрудного
отделов. Брадикардия, гипотензия, гипотермия - основные вегетативные клинические
проявления спинального шока. Нарушается перистальтика, возникает отек слизистых
мембран. Иногда встречается синдром Горнера. Потеря вазомотрного тонуса проявляется
гиперемией кожи, внутренних органов, что усугубляет проявление гипотонии (Ruge,
1977). Разрешение шока проявляется восстановлением автономных функций, рефлекторной
активности. Оценить глубину неврологического дефицита у больных в шоке тяжело.
С патофизиологической точки зрения спинальный шок -это обусловленное травмой
состояние временного угнетения рефлекторной деятельности спинного мозга. Спинальный
шок описан при различного рода экспериментальных повреждениях спинного мозга.
По Гольцу, спинальный шок - это результат травматического перераздражения спинного
мозга, что, по его мнению, доказывается большой глубиной шока при грубых перерезках
спинного мозга. Шеррингтон (1948) считает, что спинальный шок является следствием
того, что перерезка спинного мозга прерывает поступление к нему усиливающих
и облегчающих влияний головного мозга (ядра среднего мозга, варолиева моста,
продолговатого мозга и др.). Экспериментальные исследования, проведенные на
обезьянах Fulton и McCouch (1969), показали, что большое значение для возникновения
спинального шока имеет прекращение поступления к клеткам спинного мозга усиливающих
и регулирующих импульсов со стороны коры головного мозга.
Некоторые авторы рассматривают возникновение спинального шока с точки зрения
концепции о повышенной чувствительности денервированных образований (Cannon
и Rosenbluth, 1957). Этим они объясняют наступающую впоследствии повышенную
возбудимость спинного мозга. По И.П. Павлову, длительное и чрезмерно сильное
раздражение приводит к утомлению и истощению нервных клеток, вследствие чего
в них развивается торможение, предотвращающее дальнейшее истощение. При этом
торможение, не будучи самоутомлением, выступает в роли охранителя клетки. Экспериментальные
исследования, проведенные В.Н. Дроздовой (1968), позволили обнаружить при спинальном
шоке черты, характерные для охранительного торможения, - волнообразные колебания
в уровне рефлекторной активности, несоответствие выраженности рефлексов силе
раздражения, указывающее на фазовое состояние, ускорение выхода из состояния
спинального шока в условиях удлиненного физиологического сна.
Э.А. Асратян (1940) наблюдал возникновение спинального шока у собак после половинной
дорсальной перерезки спинного мозга. Спинальный шок у них иногда был выражен
даже резче, чем при полном анатомическом перерыве спинного мозга. При этом рефлексы
с конечностей, хвоста, тазовых органов не вызывались даже при сильных раздражениях.
В то же время поглаживание головы животных, показ им пищи вызывали не только
двигательную реакцию головы и передних конечностей, но также движения задних
конечностей и хвоста. Следовательно, двигательные нейроны у подопытных животных
сохраняли свою функцию. Отсюда возникло предположение о том, что исчезновение
рефлексов при глубоком спинальном шоке, а может быть, и грубые двигательные
расстройства во многих случаях обусловлены не столько поражением двигательных
нейронов, сколько нарушением функций афферентных отделов рефлекторной дуги (Э.А.
Асратян, 1940; В.Н. Дроздова,1968). Правильность предположения о меньшем поражении
двигательных нейронов, высказанного на основании результатов экспериментальных
исследований, подтверждается клиническими наблюдениями. Так, А.С. Хурина, проследившая
восстановление чувствительной и двигательной функций у 58 больных с последствиями
травмы позвоночника и спинного мозга, обнаружила, что у 53 из них восстановление
движений предшествовало восстановлению чувствительности, и только у 5 больных
раньше наступило восстановление чувствительной функции.
Изменения функционального состояния проксимального отрезка спинного мозга и
высших отделов центральной нервной системы у больных с травмой спинного мозга
были показаны исследованиями Л.Я. Лившица (1975) и Ю.В. Зотова (1980).
При исследовании периферических рефлекторно-сосудистых реакций, возникающих
в ответ на подкожное введение адреналина, у 20 больных с последствиями травмы
позвоночника и спинного мозга Л.Я. Лившиц обнаружил распространение изменения
сосудистой реакции как в областях с клинически нарушенной иннервацией (ниже
уровня повреждения спинного мозга), так и в области с клинически сохраненной
иннервацией (выше уровня повреждения спинного мозга - соответственно его проксимальному
отделу). Изменения рефлекторных сосудистых реакций проявлялись в виде: а) повышенной
чувствительности кожных сосудов к адреналину; б) резких асимметрий сосудистых
реакций; в) парадоксальных сосудистых реакций. У отдельных больных изменение
реактивности сосудов выше уровня повреждения спинного мозга было выражено даже
ярче, чем в областях, иннервация которых осуществляется при участии дистального
отрезка поврежденного спинного мозга. Полученные данные не исключали возможности
нарушения и высшей сосудистой регуляции. Ю.В. Зотовым у 27 больных с последствиями
травмы позвоночника и спинного мозга была проведена адап-тационно-холодовая
проба. У большинства больных с травмой грудного и верхнепоясничного отделов
позвоночника и спинного мозга при полном нарушении проводимости время адаптации
кожи к холоду ниже уровня травмы не изменялось, выше уровня травмы - соответственно
проксимальному отрезку спинного мозга - удлинялось. Наряду с этим были отмечены
более низкая начальная температура и значительная температурная асимметрия.
Явления спинального шока в первые часы, дни и даже недели могут обусловить
клиническую картину так называемого физиологического поперечного перерыва спинного
мозга. Эти представления согласуются с клиническими данными.
Наиболее глубокий и продолжительный спинальный шок бывает при анатомическом
перерыве спинного мозга, что характеризуется резким снижением тонуса мускулатуры
парализованных конечностей и исчезновением как соматических, так и вегетативных
рефлексов, осуществлявшихся при участии каудального отрезка спинного мозга.
Неосложненный спинальныи шок, по экспериментальным данным Э.А. Асратяна (1965),
продолжается 15-20 дней. Клинические наблюдения показывают, что спинальныи шок
у человека может быть более продолжительным. Больные выходят из такого состояния
в среднем через 4-8 нед. после травмы. Явления спинального шока у человека могут
поддерживаться и углубляться при воздействии различного рода постоянных раздражителей
(гематомы, костные отломки, металлические инородные тела, рубцы и пр.) в продолжение
многих недель, месяцев и даже лет (В.М. Угрюмов и др., 1958). Расстройства ликворо
и кровообращения, отек спинного мозга также углубляют явления спинального шока.
При травме верхних отделов спинного мозга (шейный и верхнегрудной отдел) может
быть повреждение симпатического ствола, что вызывает значительную артериальную
гипотензию, брадикардию, гипотермию при теплых нижних конечностях. Возникает
так называемая спинальная посттравматическая десимпатизация - разновидность
спинального шока, которую следует отличать от посттравматического гиповолемического
шока (артериальная гипотнезия, гипотермия, тахикардия). Спинальная десимпатизация
не только может быть связана с повреждением симпатического ствола на протяжении
Т1-L2 (Р.Л. Гелли, Д.У. Спайт, P.P. Симон, 1995), но и быть обусловлена ишемией
боковых столбов - колонок Кларка. В результате травмы позвоночника и спинного
мозга, когда повреждаются или сдавливаются передние структуры, в том числе передняя
спинальная артерия, происходит нарушение микроциркуляции спинного мозга. Больше
всего страдает пограничная зона васкуляризации между бассейном передней и задних
спинальных артерий, то есть зона медиоцентральных отделов задних рогов и колонок
Кларка. Отсутствие в этой зоне функционально значимых сосудистых анастомозов
приводит к ишемии указанной зоны, что проявляется сопутствуещей неврологической
симптоматикой, в том числе и спинальной десимпатизацией. О том, что это может
быть динамическим процессом, свидетельствует повышение тонуса симпатической
нервной системы в ответ на соответствующие медикаментозные средства.
Очень важно дифференцировать спинальныи шок как диашиз, спинальныи шок со спинальной
десимпатизацией и гиповолемический посттравматический шок при спинальной, чаще
сочетан-ной травме. При первом хирургическое вмешательство не противопоказано,
тогда как при других состояниях следует вывести больного из шока и только после
этого оперировать.
Другим явлением, встречающимся у больных со спинальной травмой в острый период
является аутономная дисрефлексия. Аутономная дисрефлексия - явление с
неясным механизмом, проявляющееся пароксизмальной гипертензией, брадикардией,
сильной пульсирующей головной болью, тревогой, выраженной потливостью кожи выше
места травмы, пароксизмальными болями в животе (R. Charbonneau-Smith, 1989).
Состояние требует симптоматического лечения, и обычно купируется в течение 2-4
дней. Случаев сочетания спинального шока с автономной дисрефлексией не описано.
После регресса острых явлений травмы возникает возможность оценить глубину
неврологического дефицита. В редких случаях травму спинного мозга можно отнести
к какому-либо специфическому неврологическому заболеванию с очерченными неврологическими
синдромами:
1. Полное повреждение спинного мозга.
2. Неполное повреждение спинного мозга:
а) передний спинальныи синдром,
б) задний спинальныи синдром,
в) синдром Броун-Секара,
г) центромедуллярный синдром,
д) синдром конуса,
ж) синдром "конского хвоста".
Полное повреждение спинного мозга является проявлением грубой травмы
спинного мозга.
Передний спинальный синдром часто отмечается при гиперфлексионных механизмах
травмы с компрессионными переломами тел позвонков иногда явлениями вывиха. Крайне
редко встречается как проявление спинальной травмы в основном при геперэкстенсионном
механизме повреждения.
Симптом Броун-Секара главным образом возникает при проникающих ранениях
спинного мозга. При травме спинного мозга в чистом виде он бывает редко, однако
у некоторых больных выявляется синдромокомплекс, подобный синдрому Броун-Секара.
У таких больных отмечается значительная тенденция к неврологическому восстановлению
в отдаленный период.
Центромедуллярный синдром наиболее часто встречается у пожилых больных
с грубым спондилезом, в шейном отделе, при наличии стеноза позвоночного канала
(Schneider, 1954). Механизмом травмы в основном является гиперэкстензия, падение
на голову, удары в теменную область. Иногда рентгенологическое исследование
не выявляет каких либо травматических костных нарушений. Неврологически синдром
проявляется слабостью, превалирующей в верхних конечностях. Часто у больных
бывают сенсорные нарушения, дизэстезии, гиперпатии, нередко обнаруживаются расстройства
функции тазовых органов, сексуальные нарушения. В отдаленный период отмечается
значительное восстановление неврологических Функций. Этот синдром описал Schneider
(1954), который считал его причиной кровоизлияния в серое вещество с отеком
прилежащего белого вещества. Однако другие иследователи показали, что такая
классическая морфологическая картина не всегда имеет место (Quencer, 1992):
были выявлены диффузные нарушения в белом веществе боковых столбов. Механизм
травмы связывают с выбуханием в позвоночный канал желтой связки и кратковременной
компрессией мозга при гиперэкстензии - растяжение рассматривается как один из
возможных механизмов при таком виде травмы.
Передний спинальный синдром также часто обнаруживается у больных с травмой
спинного мозга (Villanueva, 1994). Не редко он выявляется при компрессионных
переломах, флексионных механизмах травмы, травматических грыжах дисков. У больных
отмечается полное нарушение моторной функции и сенсорной функции боковых столбов
при сохранности функции задних столбов. Такой синдром неблагоприятен в плане
восстановления.
Синдром конуса встречается при тораколюбальной травме. При этом синдроме
в травматическое повреждение вовлекаются не только мозг, но и прилежащие корешки
"конского хвоста". Синдром представляет собой повреждение верхнего
и нижнего мотонейронов. При неполном повреждении спинного мозга у больных часто
существенно восстанавливаются неврологические функции. Нередко отмечается грубое
нарушение контроля функции тазовых органов при способности к самостоятельному
передвижению.
При наличии травматических поражений ниже L1 у больных может развиться синдром
"конского хвоста". При этом выявляются вялые парезы нижних конечностей,
арефлексия, нарушение функции тазовых органов. Обнаруживается значительная атрофия
нижних конечностей.Неврологически дефицит у таких больных часто асимметричный,
наблюдается значительное восстановление в отдаленный период.
Для унифицированной оценки неврологического статуса в 1969 г. Frankel предложил
использовать систему градаций:
A - Полное повреждение спинного мозга. Отсутствуют чувствительность
и движения ниже уровня повреждения.
B - Неполное повреждение. Сохранены все виды чувствительности ниже уровня
повреждения, за исключением фантомных видов чувствительности, движения отсутствуют.
C - Неполное повреждение. Сохранена незначительная мышечная сила, однако
движения настолько слабы, что функционального значения не имеют. Сенсорная функция
не всегда нарушена, либо нет.
D - Неполное повреждение. Сохранена мышечная сила. Сохранные движения
имеют функциональное значение и могут быть использованы для передвижения.
E - Полное выздоровление. Восстановлены все моторные и сенсорные функции.
Могут сохраняться патологические рефлексы.
Американская ассоциация спинальных повреждений предложила унифицированную систему
оценки неврологических нарушений при травме спинного мозга (шкала ASIA).
По этой системе оценивается мышечная сила в важных 10 парных дерматомах по шестибальной
шкале:
0 - плегия;
1 - визуально или пальпаторно определяемое сокращение мышцы;
2 - активные движения, не способныепротивостоять гравитационной силе;
3 - активные движения, способные противостоять гравитационной силе;
4 - активные движения в полном объеме, которые могут противостоять умеренному
сопротивлению;
5 - активные движения в полном объеме, которые могут противостоять сильному
сопротивлению.
Двигательные функции оцениваются проверкой силы в 10 контрольных группах
мышц и соотносятся с сегментами спинного мозга:
1. С5 - сгибание в локте (biceps, brachioradialis).
2. С6 - разгибание запястья (extensor carpi radialis longus and brevis).
3. C7 - разгибание в локте (triceps).
4. C8 - сгибание пальцев кисти (flexor digitorum profundus).
5. T1 - приведение мизинца (abductor digiti minimi).
6. L2 - сгибание бедра (iliopsoas).
7. L3 - сгибание колена (quadriceps).
8. L4 - тыльная экстенсия стопы (tibialis anterior).
9. L5 - разгибание большого пальца (extensor hallucis longus).
10. S1 - тыльная флексия стопы (gastrocnemius, soleus).
Максимально возможное значение по данной шкале - 100 баллов.
Чувствительность проверяется в контрольных для каждого сегмента точках
и оценивается по следующей шкале:
0 - отсутствие чувствительности.
1 - нарушение чувствительности.
2 - нормальная чувствительность.
Чувствительность и двигательные функции оцениваются с двух сторон и баллы,
набранные в каждом сегменте, суммируются. При оценке мышечной силы максимальная
сумма балов для 10 сегментов каждой стороны равна 50, при проверке чувствительности
для 28 сегментов каждой стороны - 56 баллов.
По степени травмирования спинного мозга все виды неврологических повреждений
классифицируются следующим образом:
А - полное повреждение: ни двигательных, ни чувствительных функций не
выявляется, нет никаких признаков анальной чувствительности в S4-S5-сегментах;
В - неполное повреждение: двигательные функции отсутствуют ниже уровня
травмы, но сохранены элементы чувствительности в S4-S5-сегментах;
С - неполное повреждение: двигательные функции сохранены ниже уровня
травмы и в большинстве контрольных групп мышц сила менее 3 баллов;
D - неполное повреждение: двигательные функции сохранены ниже уровня
травмы и в большинстве контрольных групп мышц сила равна 3 баллам или большая;
Е - норма: двигательные и чувствительные функции не нарушены.
При оценке статуса используется понятие неврологического уровня повреждения,
который определялся как наиболее каудальный уровень с нормальными двигательными
и чувствительными функциями (уровень с неизмененной чувствительностью и силой
мышц не менее 3 баллов). По этой системе классификации неврологическое повреждение
считается полным при отсутствии моторной и сенсорной функций в обоих сакральных
сегментах (S4-S5). При наличии чувствительности или движений в данных сегментах
повреждение рассматривается как неполное. Как показано работами Stauffer и Waters,
(1982) такая оценка наиболее информативна в определении прогноза и степени последующего
неврологического восстановления. В классификацию включено понятие "зона
травмы" - которое теперь изменено на понятие "зона частичного нарушения"
(1992 г.). Этой зоной считается количество сегментов, расположенных ниже неврологического
уровня, где частично сохраняется иннервация (American Spinal Injury Association
-ASIA; 1992).
ЛИТЕРАТУРА
1. ГЕЛЛИ Р.Л., СПАЙТ Д.У., Симон P.P. Неотложная ортопедия. Позвоночник. - М.:
"Медицина", 1995, 420 с.
2. ДРОЗДОВА В.Н. К физиологии спинального шока. - В кн.: Вопросы экспериментального
и клинического изучения последствий травмы спинного мозга. - М., 1956, С. 36-48.
3. ЛИВШИЦ А.В. Хирургия спинного мозга. М.: "Медицина", 1990, 330 с.
4. УГРЮМОВ В.М. Осложнения травмы позвоночника и спинного мозга. - В кн.: Многотомное
руководство по неврологии. - М., 1962. - Т. 8. - С. 588.
5. ALBIN M.S. Acute cervical spinal injury // Crit. Care Clin. - 1985. - Vol.
3. - P. 267.
6. American College of Surgeons Committee on Trauma: Advanced Life Support Course
Student Manual. Chicago, American College of Surgeons, 1989.
7. American College of Surgeons Committee on Trauma: Advanced Trauma Life Support.
Chicago, American College of Surgeons, 1985.
8. American Spinal Injury Association: Standards for Neurological Classification
of Spinal Cord Patients. Chicago, American Spinal Injury Association, 1982.
9. American Spinal Injury Association: Standards for Neurological Classification
of Spinal Cord Patients. Chicago, American Spinal Injury Association, 1992.
10. BRACKEN M.B., SHEPARD M.J., COLLINS W.F. et al. A randomized, controlled trial
of methylprednisolone or naloxone in the treatment of acute spinal-cord injury
// N. Engl. J. Med. - 1990. - Vol. 322.-P. 1405-1411.
11. BRAUGHLER J.M., HALL E.D. Current application of "high-dose" steroid
therapy for CNS injury: A pharmacological perspective // J. Neurosurg. - 1985.
- Vol. 62. - P. 806-810.
12. DEMEDIUK P., SAUNDERS R.D., ANDERSON D.K. et al. Membrane lipid changes in
laminectomized and traumatized cat spinal cord // Proc. Nati. Acad. Sci. USA.
- 1985. - Vol. 82. - P. 7071-7075.
13. DUH M.-S., SHEPARD M.J., WILBERGER M.D. et al. The effectiveness of surgery
on the treatment of acute spinal cord injury and its relation to pharmacological
treatment [Discussion] // Neurosurgery. - 1994. - Vol. 35. - P. 248-249.
14. FADEN AL., LEMKE M., DERNEDIUK P. Effects of BW755C, a mixed cyclo-oxygenase-lipoxygenase
inhibitor, following traumatic spinal cord injury in rats // Brain. Res. - 1988.
- 463. - P. 63-68.
15. FAGAN S.C., CASTELLANI D., GENGO F.M. Prostanoid concentrations in human CSF
following acute ischaemic brain infarction // Clin. Exp. Pharmacol. Physiol. -
1986. - Vol. 13, 10. - P. 629-632.
16. FRANKEL H.L., HANCOCK D.O., HYSLOP G. et al. The value of postural reduction
in the initial management of closed injuries of the spine with paraplegia and
tetraplegia // Paraplegia. - 1969. - 7. - P. 179-192.
17. GEISLER F.H., DORSEY F.C., COLEMAN W.F. Recovery of motor function after spinal-cord
injury: A randomized, placebo-controlled trial with GM-I ganglioside // N. Engl.
J. Med. - 1991. - Vol. 324.-P. 1829-1838.
18. GREEN B.A., EDGAR R. Spinal injury pain. In Long D.M. ed.: Current Therapy
in Neurological Surgery // Philadelphia, B.C. Decker. - 1989. - P. 294-297.
19. GREEN B.A., KLOSE K.J. Spinal cord regeneration: The laboratory/clinical interface.
In Bodis Wollner I., Zimmerman E.A. eds.: Neural Regeneration and Transplantation.
Vol. 6. New York, Alan R. Liss, 1989, P. 171-182.
20. GREEN B.A., MAGANA I. Spinal cord trauma: Clinical aspects. In Davidoff R.,
ed.: Handbook of the Spinal Cord. Vols. IV and V. New York, Marcel Dekker, 1987,
P. 63-92.
21. GREEN B.A., EISMONT F.J., KLOSE K.J. Management of cervical cord lesions including
advances in rehabilitative engineering. In Camins M.B., O'Leary P.F. eds.: Disorders
of the Cervical Spine. Baltimore, Williams & Wilkins, 1992, P. 351-367.
22. GREEN B.A., GREEN K.L., KLOSE K.J. Kinetic therapy for spinal cord injury
// Spine. - 1983. - Vol. 8. - P. 722-728.
23. GREEN B.A., KHAN Т., KLOSE K.J. A comparative study of steroid therapy in
acute experimental spinal cord injury // Paraplegia. - 1980. - Vol. 18. - P. 181-186.
24. GREEN B.A., KLOSE K.J., GOLDBERG M.L. Clinical and research considerations
in spinal cord injury. In Becker D., Poviishock J. eds.: NIH Central Nervous System
Trauma Status Report. Bethesda, MD, National Institutes of Health, 1985, P. 341-368.
25. GREEN B.A., KLOSE K.J., EISMONT F.J. et al. Immediate management of the spinal
cord injured patient. In Lee B.Y., Ostrander L., Cochran V.B., Shaw W.W. eds.:
The Spinal Cord Injured Patient: Comprehensive Management. Philadelphia, W. B.
Saunders, 1991, P. 24-33.
26. GREEN B.A., EISMONT F.J., O'HEIR J. Spinal cord injury: A systems approach:
Prevention, emergency medical services, and emergency room management // Crit.
Care Clin. - 1987. - Vol. 3. - P. 471-494.
27. GREEN B.A., GABRIELSON M., HALL W.J. et al. Analysis of swimming pool accidents
resulting in spinal cord injury // Paraplegia. - 1980. - Vol. 18. - P. 94-100.
28. GUTTMANN L. Spinal Cord Injuries: Comprehensive Management and Research. Oxford,
Blackwell Scientific, 1973.
29. Hsu С.У., HALUSHKA P.V., HOG AN E.L. et al. Alteration of thrornboxane and
prostacyclin levels in experimental spinal cord injury // Neurology. - 1985. -
Vol. 35. - P. 1003-1009.
30. Hsu C.Y., HALUSHKA P.V., HOGAN EX., Cox R.D. Increased thrombox-ane level
in experimental spinal cord injury // J. Neurol. Sci. - 1986. - Vol. 74. - P.
289-296.
31. Hsu C.Y., HALUSHKA P.V., SPICER K.M. et al. Temporal profile of thromboxane-prostacyclin
imbalance in experimental spinal cord injury // Neurol. Sci. - 1988. - Vol. 83.
- P. 55-62.
32. KIWAK K.J., MOSKOWITZ M.A., LEVINE L. Leukotriene production in gerbil brain
after ischemic insult, subarachnoid hemorrhage, and concussive injury // /. Neurosurg.
- 1985. - Vol. 62. - P. 865-869.
33. KLOSE K. J., GREEN B.A., SMITH R.S. et al. University of Miami Neurospinal
Index: A quantitative method for determining spinal cord function // Paraplegia.
- 1980. - Vol. 28. - P. 331-336.
34. LEVI L., WOLF A., BELZBERG H. Hemodynamic parameters in patients with acute
cervical cord trauma: Description, intervention and prediction of outcome // Neurosurgery.
- 1993. - Vol. 33. - P. 1007-1016.
35. MlTSUHASHI Т., LKATA Т., MORHNOTO K. et al. Increased production of eicosanoids,
TXA, PGI and LTC in experimental spinal cord injuries // Paraplegia. - 1994. -
Vol. 32. - P. 524-530.
36. QUENCER R.M., BUNGE R.P., EGNOR M. et al. Acute traumatic central cord syndrome:
MRI-pathological correlations // Neuroradiology. - 1992. - Vol. 34. - P. 8-94.
37. RUGE D. Spinal cord injuries. - Springfield, Thomas, 1969.
38. SCHNEIDER R.C. The syndrome of acute anterior spinal cord injury // J. Neurosurg.
- 1955. - Vol. 12.-P. 95-122.
39. SCHNEIDER R.C. The syndrome of acute central cervical spinal cord injury //
J. Neurosurg. - 1954. - Vol. 11. - P. 546-577.
40. SHARMA H.S., OLSSON Y., CERVOS-NAVARRO J. Early perifocal cell changes and
edema in traumatic injury of the spinal cord are reduced by indomethacin, an inhibitor
of prostaglandin synthesis: Experimental study in the rat // Ada.
Neuropathol. - 1993. - Vol. 85. - P. 145-153.
41. TATOR C.H., FEHIINGS M.G. Review of the secondary injury theory of acute spinal
cord trauma with emphasis on vascular mechanisms // J. Neurosurg. - 1991. - Vol.
75. - P. 15-26.
42. TEMPEL G.E., MARTIN H.F. III. The beneficial effects of a thromboxane receptor
antagonist on spinal cord perfusion following experimental cord injury // J. Neurol.
Sci. - 1992. - Vol. 109. - P. 162-167.
43. VILLANUEVA P., PATCHEN S.J., GREEN B.A. Spinal cord injury: An ICU challenge
for the 1990's. In Sivak E., Higgins Т., Seiver A. eds.: The High Risk Patient:
Management of the Critically III. Philadelphia, Lea & Febiger, 1994, P. 146-159.
44. WILCOX N.E., STAUFFER E.S. Follow-up of 423 consecutive patients admitted
to the spinal cord injury center, Rancho Los Amigos Hospital, January I to December
31, 1967 // Paraplegia. - 1972.-Vol. 10.-P. 115-122.
45. WINKLER Т., SHARMA H.S., STALBERG E., OLSSON Y. Indomethacin, an inhibitor
of prostaglandin synthesis attenuates alteration in spinal cord evoked potentials
and edema formation after trauma to the spinal cord: An experimental study in
the rat // Neuroscience. - 1993. - Vol. 52. - P. 1057-1067.
return_links(2); ?> |
